Los perfiles moleculares obtenidos tanto de DNA como de RNA tumoral pueden guiar el manejo clínico de los pacientes con cáncer, aportando información para el diagnóstico, pronóstico o para la identificación del tratamiento personalizado potencialmente idóneo en cada paciente, determinando su elegibilidad para la administración de:
- Una terapia dirigida aprobada para su tipo de tumor y perfil molecular.
- Una terapia dirigida disponible para su alteración molecular específica pero aprobada en otro tipo de tumor.
- Una terapia dirigida, disponible sólo en ensayos clínicos con fármacos en desarrollo, para su alteración molecular específica.
Por último, las alteraciones moleculares pueden ser de utilidad en la monitorización de la respuesta a determinados tratamientos dirigidos.
En la actualidad, el estudio del perfil molecular de neoplasias como la de pulmón, colon, ovario, endometrio, vejiga, tiroides y melanoma, entre otras, requiere la caracterización de varios genes diferentes. Los estudios se realizan gen a gen, cada uno con una técnica específica, lo que hace imprescindible disponer de suficiente tejido tumoral de partida para realizar todos los estudios y supone una elevada inversión de tiempo en la realización, análisis e interpretación de cada uno de ellos.
Con el fin de escapar de estas limitaciones, conseguir mejorar los tiempos de respuesta y evitar que la escasa disponibilidad de DNA y/o RNA impida el estudio completo de todos los genes implicados en cada neoplasia se han desarrollado las nuevas tecnologías de Next Generation Sequencing (NGS), conocidas también como técnicas de secuenciación masiva. La NGS permite el estudio de múltiples genes en un único ensayo partiendo de una concentración inicial de DNA o RNA extremadamente baja (10ng) y sus aplicaciones son diversas, permitiendo secuenciar desde el genoma completo del paciente a paneles de genes seleccionados como relevantes según la neoplasia en estudio.
BIOPSIA LÍQUIDA
El término biopsia líquida en oncología engloba dos conceptos distintos, la detección de células tumorales circulantes (CTCs) liberadas al torrente sanguíneo desde tumores primarios o metástasis y la detección de DNA tumoral circulante (ctDNA) procedente de células tumorales apoptóticas. La presencia de ctDNA fue descrita en 1977 no obstante, debido a su fragmentación y la baja de proporción de ctDNA presente en plasma, su utilidad clínica se ha visto íntimamente ligada a la aparición de nuevas tecnologías de alta sensibilidad como la PCR cuantitativa alelo-específica, la PCR digital, BEAMing y técnicas secuenciación masiva. Estas nuevas tecnologías abren un amplio abanico de aplicaciones clínicas para el estudio de ctDNA: - Caracterización de tumores en pacientes donde no es posible obtener una biopsia. - Aparición de resistencias al tratamiento. - Factor pronóstico. - Seguimiento no invasivo.
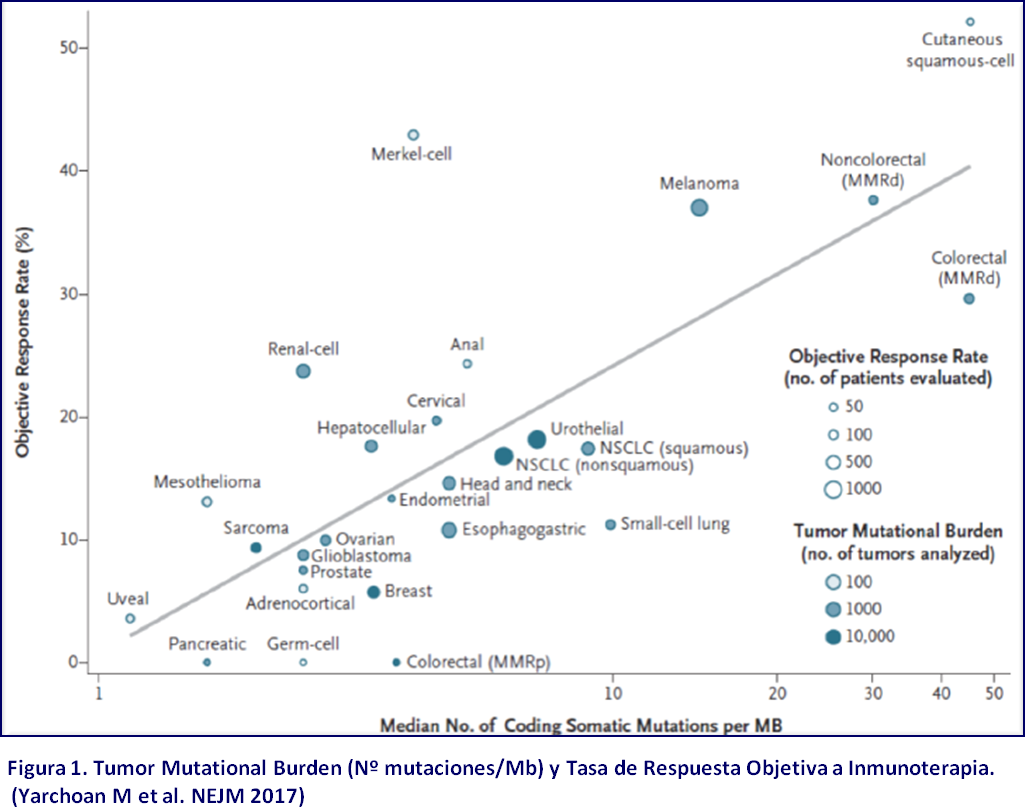
TUMOR MUTATIONAL BURDEN (TMB) O CARGA MUTACIONAL TUMORAL: ANÁLISIS Y CUANTIFICACIÓN DEL TMB MEDIANTE SECUENCIACIÓN MASIVA
La aparición de inhibidores de checkpoints inmunes ha cambiado el paradigma de tratamiento en varios tipos de tumores sólidos. La selección de pacientes potencialmente susceptibles de responder a estos tratamientos precisa de biomarcadores predictivos robustos. Actualmente se está estableciendo el papel del Tumor Mutational Burden (TMB), o Carga Mutacional Tumoral, como factor predictivo de respuesta a inmunoterapia. El TMB se define como el número de mutaciones somáticas detectadas por Megabase de DNA tumoral (nº mutaciones/Mb).
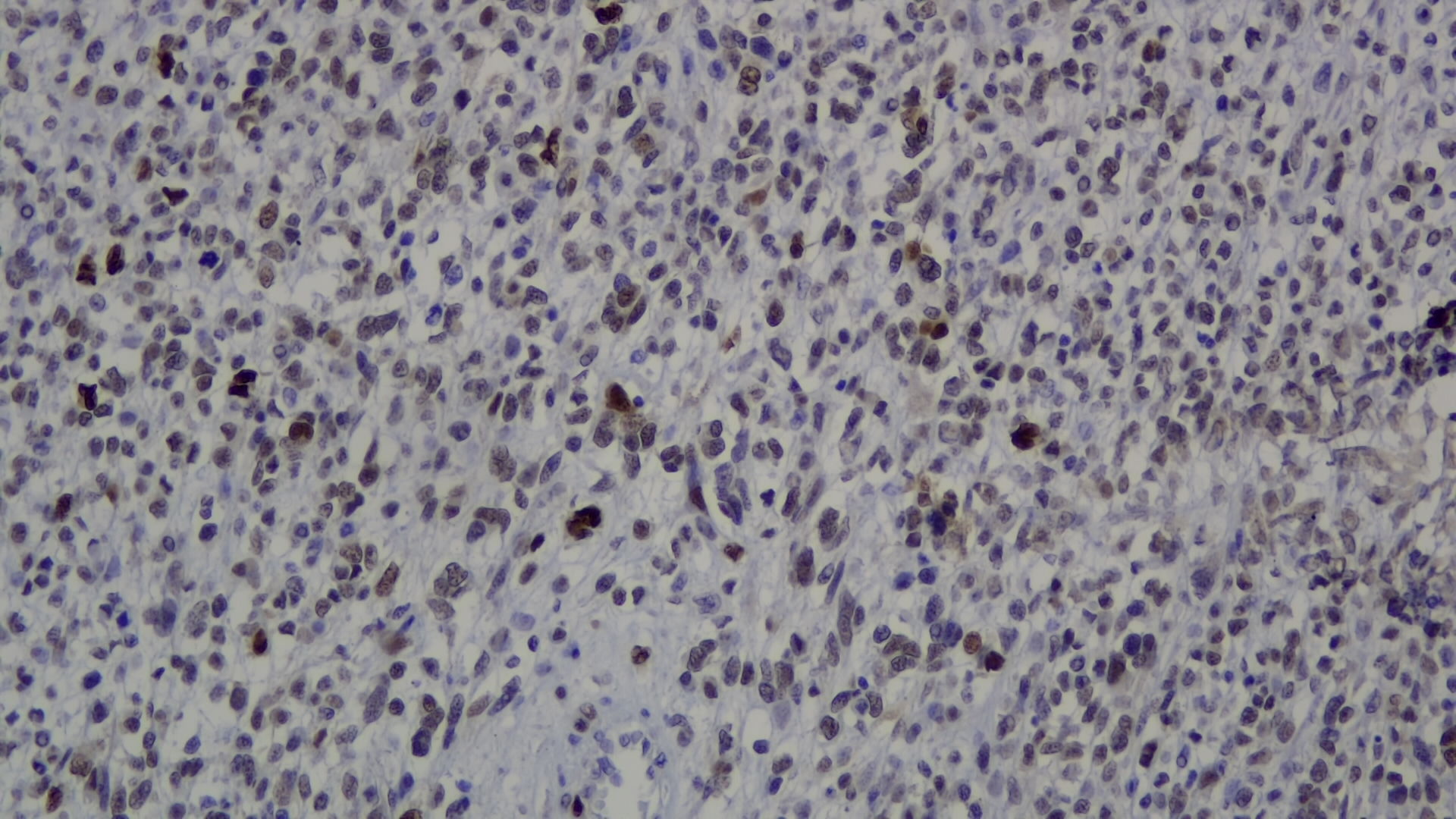
MURINE DOUBLE MINUTE 2 (MDM2)
MDM2 es una fosfoproteína nuclear cuya transcripción es activada por el gen P53 y que, a su vez, enlaza con P53 eliminando su bloqueo sobre el ciclo celular. La expresión nuclear de MDM2 se ha demostrado como característica del liposarcoma bien diferenciado y del liposarcoma desdiferenciado. Su utilidad en el primer caso es el diagnóstico diferencial con lipoma. En el liposarcoma desdiferenciado permite distinguirlo de otros tipos de sarcomas de alto grado. La expresión inmunohistoquímica de MDM2 se presenta también en otros sarcomas de baja incidencia como el sarcoma intimal de arteria pulmonar y el osteosarcoma de bajo grado. También se presenta en tumores óseos de células gigantes, gliomas y algunas neoplasias epiteliales. El estudio de MDM2 puede también efectuarse o complementarse demostrando su amplificación con FISH.
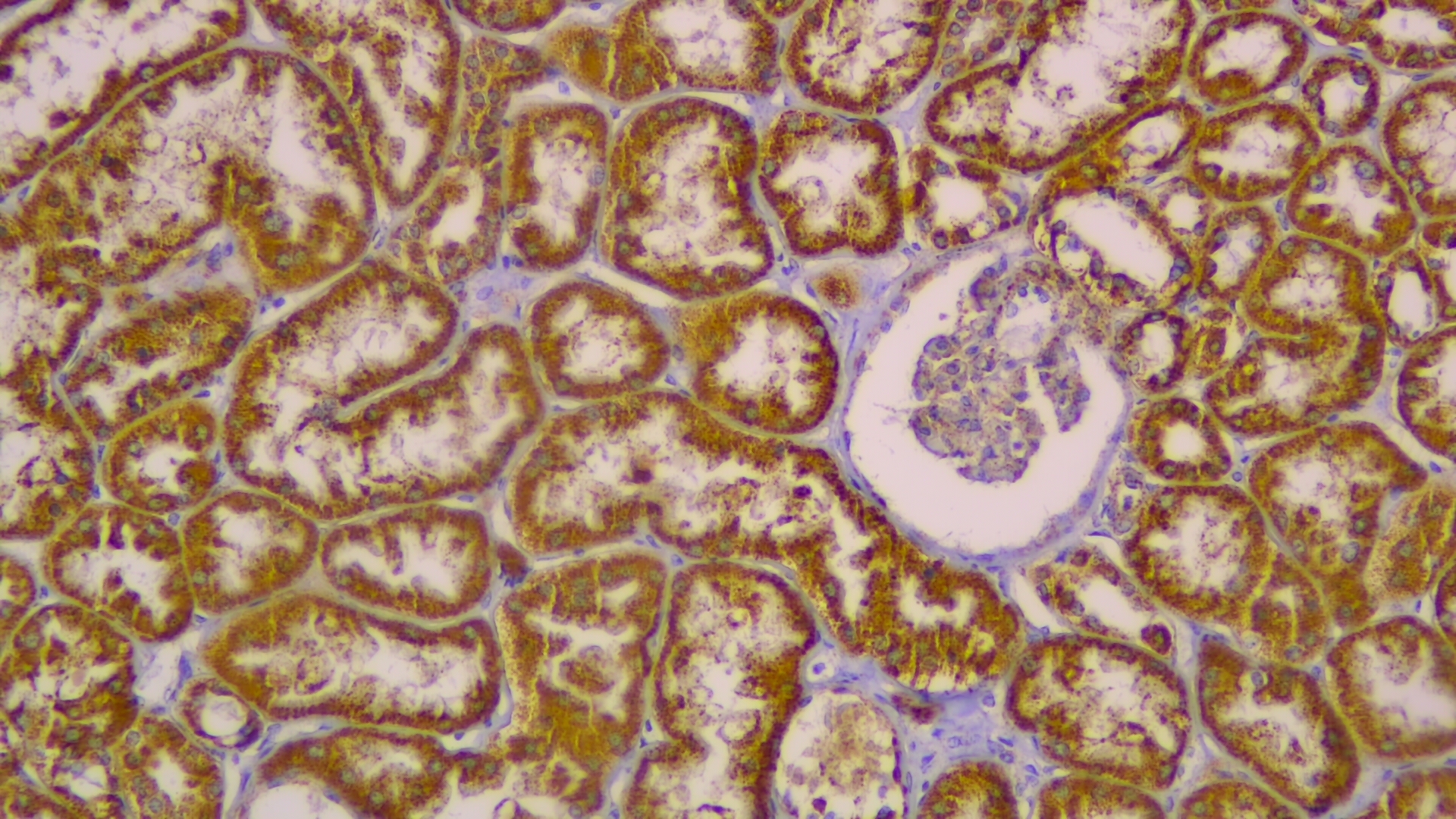
FUMARATO HIDRATASA (FH)
La fumarato hidratasa es una enzima metabólica que forma parte del ciclo de Krebs y cataliza reversiblemente la hidratación del fumarato a malato. En condiciones de normalidad la inmunohistoquímica detecta su expresión en el citoplasma celular. Sus mutaciones en línea germinal se asocian con el síndrome de leiomiomatosis hereditaria y carcinoma de células renales y su pérdida de expresión inmunohistoquímica permite el diagnóstico en fases tempranas de la enfermedad. También predisponen a leiomiomas uterinos o cutáneos y a carcinoma renal papilar tipo II.